近日,我院动物科学技术学院、动物医学院、农业微生物资源发掘与利用全国重点实验室李文涛教授团队在猪德尔塔冠状病毒入侵细胞的分子机制研究领域取得重要进展。相关成果以“Genome-wide CRISPR/Cas9 library screen identifies C16orf62 as a host dependency factorfor porcine deltacoronavirus infection”为题在Emerging Microbes & Infections期刊上发表。
猪德尔塔冠状病毒(Porcine deltacoronavirus,PDCoV),是一种新型猪肠道冠状病毒, 主要感染新生仔猪,引起腹泻、呕吐、脱水甚至死亡,给全球养猪业带来巨大经济损失。此外,据报道,从海地三名发热儿童血清样本中检测并分离到了PDCoV,表明该病毒具有跨种传播的风险。PDCoV 主要通过S蛋白与细胞受体/共受体结合,从而介导病毒入侵宿主细胞。前期团队研究表明,PDCoV以氨基肽酶N(APN)作为细胞受体,但APN的敲除并不能完全阻止病毒的感染,提示还有其他受体或辅助受体参与了病毒感染过程。
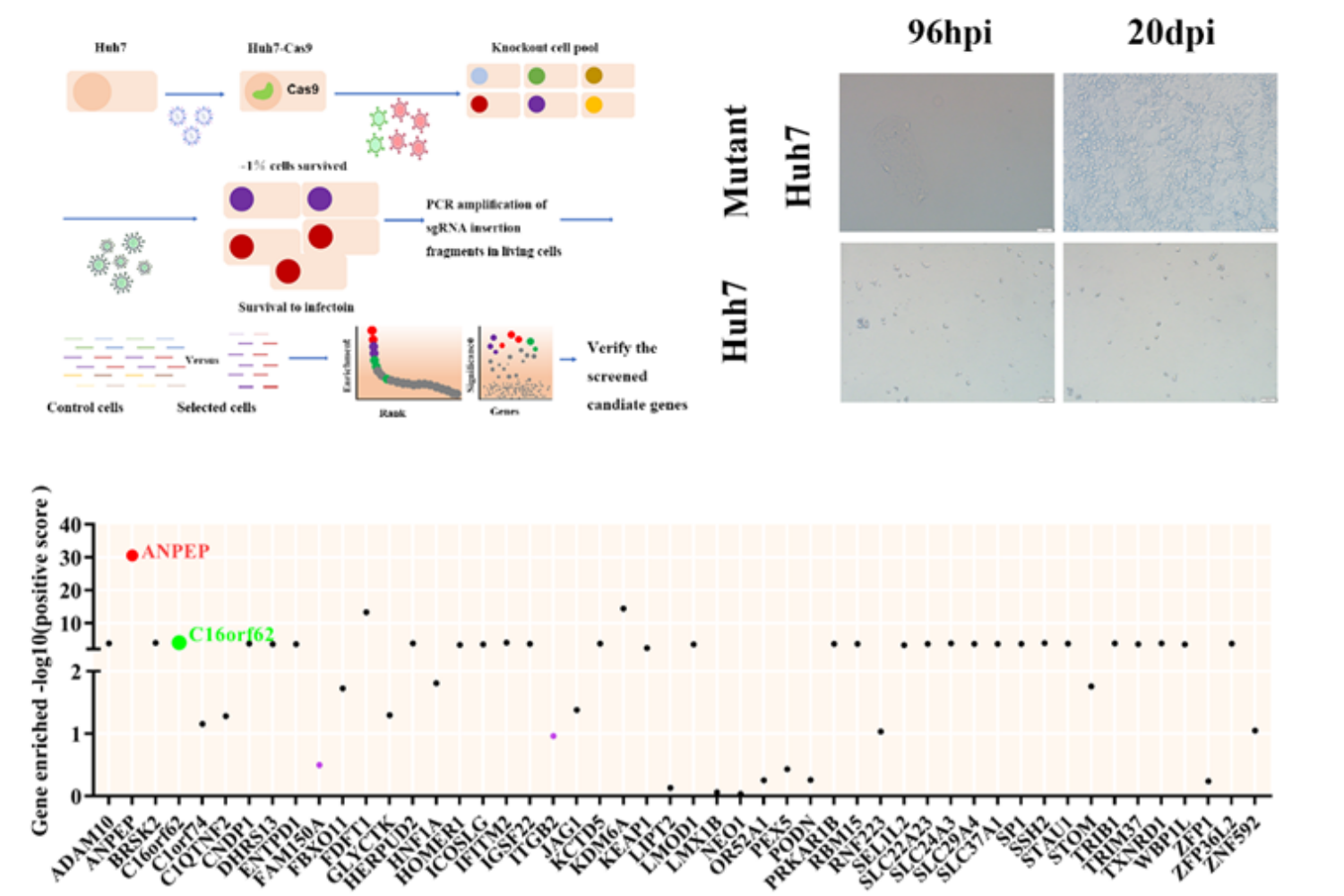
为发掘PDCoV的受体及感染相关的宿主因子,研究人员将 PDCoV 感染 CRISPR/Cas9 敲除慢病毒文库转导的易感细胞-人肝癌 Huh7 细胞,并对存活细胞进行高通量测序(NGS)和基因富集分析,发现除了已知受体基因 ANPEP,还有 C16orf62 等多个参与病毒感染过程的基因显著富集。通过在猪源细胞进行基因敲除和病毒感染试验证实 C16orf62 是PDCoV 吸附过程中重要的宿主因子。尽管没有发现C16orf62与PDCoV S蛋白的直接互作关系,但经过验证发现,C16orf62 敲除细胞系APN的表达下调。进一步通过TGEV S1在C16orf62敲除细胞系上进行表面染色以及接种TGEV验证,发现C16orf62敲除细胞表面APN丰度降低。最后进行Co-IP验证及共聚焦观察发现C16orf62与APN可以相互作用。表明C16orf62作为异源逆向囊泡转运复合物retriever的核心组分,可通过调节细胞膜上已知受体APN的分布,间接影响PDCoV的吸附而参与PDCoV的感染过程。
研究揭示了C16orf62为PDCoV感染细胞的必需宿主因子,为进一步揭示冠状病毒的致病机理奠定基础,为抗冠状病毒药物的研制和抗病育种提供潜在的靶标。
我院博士生马宁宁和博士后张梦佳为文章共同第一作者,李文涛教授和荷兰乌特勒支大学Berend Jan Bosch教授为通讯作者。感谢何启盖教授和荷兰乌特勒支大学医学中心Robert Jan Lebbink博士对本研究提供的重要指导意见和建议。
原文链接:https://doi.org/10.1080/22221751.2024.2400559